Європейська ліга проти ревматизму (EULAR) розробила свої перші рекомендації щодо лікування ревматоїдного артриту (РА) за допомогою синтетичних та біологічних хворобомодифікуючих антиревматичних препаратів (ХМАРП) у 2010 році. Сьогодні загальновизнано, що клінічна ремісія є основною терапевтичною ціллю для пацієнтів з низькою активністю захворювання і що для пацієнтів з РА слід застосовувати стратегію “лікування до цілі”.
Хоча відповідні дані накопичуються швидко, деякі рекомендації, навіть в оновленому гайдлайні 2016 року, ґрунтувалися на досить низькому рівні доказів, і багато спеціалістів розпочали інтенсивні дебати через різну інтерпретацію доказів та емпіричний підхід. Виконавчий комітет EULAR схвалив пропозицію оновити рекомендації. Ми хотіли отримати глобальний внесок та врахувати погляди з регіонів світу за межами Європи тому запросили ревматологів з Азії, Латинської та Північної Америки зробити свій внесок у обговорення та формулювання цих рекомендацій.
Основним напрямком рекомендацій EULAR продовжує залишатися фармакологічна терапія за допомогою ХМАРП. Поняття "хворобомодифікуюча" включає: полегшення ознак та симптомів; поліпшення фізичних функцій, якості життя, соціальної працездатності; а також пригнічення виникнення та прогресування структурних пошкоджень хряща та кістки. Останнє відрізняє ХМАРП від простих симптоматичних засобів, таких як нестероїдні протиревматичні препарати.
Результати
EULAR розробив низку документів, що стосуються безпеки лікарських засобів, які використовуються для лікування РА. Були розроблені рекомендації щодо вакцинації, а також оцінка, що дозволяє розрахувати ризик інфекційних захворювань у пацієнтів, які приймають біологічні ХМАРП (б-ХМАРП).
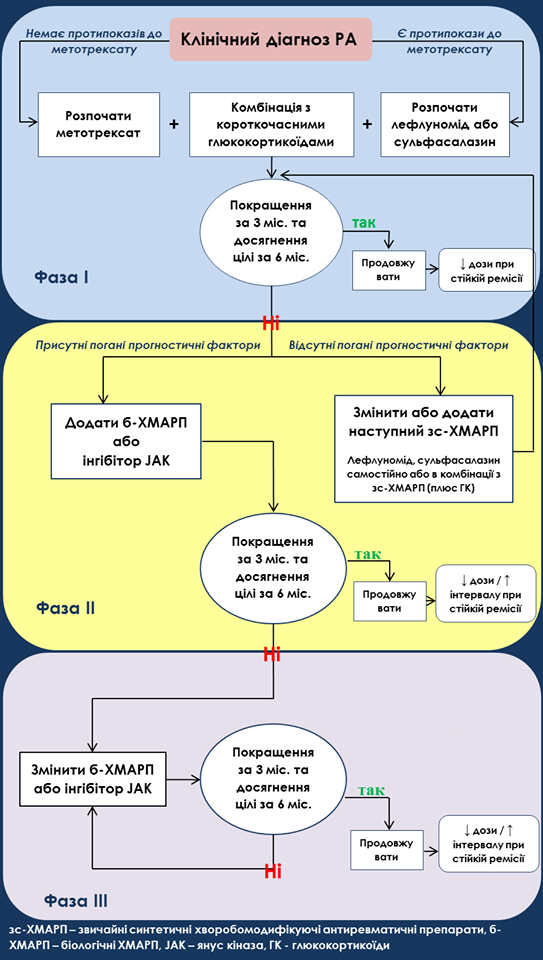
Класифікуючи ХМАРП, цільова група дотримувалася раніше використовуваної номенклатури, як показано в таблиці 1. Ця таблиця також містить словник термінів, які використовуються у цьому документі. Цільова група не розрізняла ранній та встановлений РА, а зробила розподіл між трьома фазами лікування, диференціюючи пацієнтів, які відповідають на будь-яку терапію ХМАРП (фаза I); пацієнтів, які мали недостатню відповідь (НВ) на початковий курс звичайних синтетичних ХМАРП (зс-ХМАРП) (фаза II); і тих, у кого була НВ на перший б-ХМАРП або таргетний синтетичний ХМАРП (тс-ХМАРП) (фаза III). Цільова група також враховувала прогностичні фактори (таблиця 1), які мають аналогічну прогнозовану силу незалежно від тривалості захворювання.
Загальні принципи
Як і раніше, цільова група підкреслювала необхідність дотримання деяких загальних принципів при лікуванні хворих на РА. Ці принципи є основою, на якій ґрунтуються фактичні рекомендації. До 2013 року існували три загальні принципи; у 2016 році цільова група додала четвертий принцип як всебічний принцип B. Тепер ще один пункт з'явився як загальний принцип D, в результаті чого було оновлено п'ять загальних принципів 2019 року.
A. Лікування хворих на РА повинно бути спрямоване на найкращий догляд і має базуватися на спільному рішенні між пацієнтом та ревматологом.
Цей принцип залишився незмінним. Під час обговорення було підтверджено важливість спільного прийняття рішень та наголошено на важливості навчання пацієнтів. Висловлювались пропозиції щодо розширення цього пункту, а саме було вирішено, що навчання пацієнтів є невіддільною основою для спільного прийняття рішень. Тим не менш, оскільки спільне прийняття рішень є таким важливим, навички спілкування також повинні бути в центрі уваги ревматологів та інших медичних працівників. Цей пункт також включений у публікацію про показники якості, які слід включити до процесу прийняття рішень. Слід також зазначити, що цільова група була зосереджена на ХМАРП, а не на інших фармакологічних та нефармакологічних видах терапії, які доведеться розглядати у багатьох пацієнтів як допоміжну терапію.
B. Рішення щодо лікування ґрунтуються на активності захворювання, проблемах безпеки та інших факторах пацієнта, таких як супутні захворювання та прогресування структурних пошкоджень.
Цей принцип доданий у 2016 році і є особливо важливим при розгляді питання використання б-ХМАРП та тс-ХМАРП. Вищий ризик зараження herpes zoster при прийомі інгібіторів JAK (Janus kinase – янус кіназа) є більш вираженим у деяких азіатських країнах, таких як Японія та Південна Корея. Також було обговорено поширену дискусію щодо ризику венозних тромбоемболічних подій (ВТП) у пацієнтів з ожирінням або попередньою ВТП в анамнезі.
C. Ревматологи - це спеціалісти, які мають здійснювати первинний догляд за хворими на РА.
Незмінний від попередніх рекомендацій, цей принцип стосується важливості спеціального догляду за таким складним захворюванням як РА, оскільки ревматологи мають оптимальну глибину та широту досвіду щодо використання всіх типів ХМАРП, включаючи ефективність, оцінку ризику та знання супутніх захворювань (як обговорювалося у пункті В). Важливо, що медичні працівники, такі як медичні сестри з ревматології, також опікуються багатьма аспектами, пов'язаними з менеджментом РА та навчанням пацієнтів. Крім того, деякі супутні захворювання, такі як хронічний гепатит, інтерстиціальна хвороба легенів або серцево-судинні події, можуть потребувати консультації та лікування інших фахівців.
D. Пацієнтам необхідний доступ до декількох препаратів з різними способами дії для усунення гетерогенності РА; їм може знадобитися кілька послідовних видів терапії протягом життя.
Розробка цього нового всеохоплюючого принципу вважалася необхідною та своєчасною з огляду на збільшення кількості лікарських засобів, доступних для лікування РА. Наразі відомо п’ять молекулярних таргетних сімейств (фактор некрозу пухлини (TNF), інтерлейкін 6 (IL-6), CD80/86, CD20 та янус кіназа (JAK)) з декількома препаратами для цих молекул. Для ремісії або низької активності захворювання (див. Рекомендації 2 та 3) потенційно потрібно перемикатися між препаратами, іноді навіть кожні 3 місяці, якщо поліпшення відповідно до стратегічних принципів є недостатнім. Більше того, встановлено, що після неефективності одного препарату інший, який належить до того ж класу (тобто націлений на одну і ту ж молекулу), все ще може бути ефективним. Тому пацієнти, ревматологи та платники повинні знати, що для досягнення терапевтичної мети часто потрібні кілька послідовних варіантів прийому ліків. Це не обов'язково спричиняє додаткові витрати, оскільки продовження (частково) відмови від ХМАРП може бути таким же дорогим, як і перехід на інший ХМАРП. Цей пункт стосується додаткової важливої характеристики: РА - це хвороба на все життя, причина якої невідома і яка - як і багато інших хронічних розладів - наразі не може бути вилікована у більшості пацієнтів, але може знаходитись у ремісії при адаптації до лікування, використовуючи весь спектр терапії, доступний сьогодні. Таким чином, ремісія - це найкраще, чого можна досягти при подальшому зменшенні дози препарату. Хоча підхід до зменшення ліків розглядається в рекомендаціях 11 і 12, пацієнти, ревматологи, платники та громада повинні усвідомити, що багато пацієнтів не зможуть припинити терапію і потребуватимуть лікування протягом усього життя. До 50% пацієнтів, які починають приймати новий ХМАРП, повинні припинити прийом протягом 12-18 місяців через недостатню ефективність або побічні явища. Дійсно, багато пацієнтів досі не досягають терапевтичних цілей, незважаючи на всі наші сучасні методи терапії, але все ж приблизно 10-20% пацієнтів, які не приймають багато препаратів, мають хорошу реакцію на лікування ще одним препаратом.
E. РA несе високі індивідуальні, медичні та суспільні витрати, і все це має враховуватись лікуючим ревматологом.
Цей (незмінний) принцип нагадує всім зацікавленим сторонам про важливий баланс. З одного боку, ефективна терапія РА може зменшити економічне навантаження на окремих пацієнтів, їх сім'ї та суспільство. Цей економічний тягар включає не лише прямі витрати на медичну допомогу, але й непрямі витрати через лікарняні відпустки, втрату працездатності та передчасну пенсію. З іншого боку, висока ціна багатьох діючих препаратів спричиняє чисте збільшення економічного навантаження на суспільство. Тому при прийнятті терапевтичних рішень слід віддати перевагу менш затратним препаратам, якщо вони аналогічно ефективні, безпечні та відповідають терапевтичним парадигмам так як і дорожчі препарати. Як було зазначено у вступі, у багатьох країнах високі витрати на лікування обмежують доступність сучасних методів терапії (нерівність). Наявність біосимілярів може вирішити цю проблему та забезпечити значне скорочення бюджетів на охорону здоров'я, тому що їх ціна є достатньо низькою.
Рекомендації
1. Терапію ХМАРП слід починати одразу після діагностування РА. Цей незмінний елемент є основним принципом лікування РА, оскільки захворювання не закінчиться спонтанно. (Рівень доказовості - 1a, сила рекомендації – A)
2. Лікування повинно бути спрямоване на досягнення мети стійкої ремісії або низької активності захворювання (НАЗ) у кожного пацієнта (без змін). ACR (American College of Radiology – американський коледж радіології) та EULAR домовились про визначення ремісії на основі балів та індексів (використовуючи спрощений або клінічний індекс активності захворювання SDAI, CDAI). Як визначено принципом А, ціль лікування має бути узгоджено в процесі спільного прийняття рішень. (Рівень доказовості - 1a, сила рекомендації – A)
3. При активному захворюванні моніторинг повинен бути частим (кожні 1–3 місяці); якщо поліпшення не відбулося не пізніше ніж через 3 місяці після початку лікування або мета не була досягнута до 6 місяців, терапію слід скорегувати (не змінити). При адаптації до лікування слід враховувати бажану ціль лікування, а також різні фактори пацієнта, включаючи супутні захворювання. Швидке досягнення обраної цільової кінцевої точки тепер вважається критично важливим. Хоча прямих доказів щодо питання про кращий момент часу для прийняття рішень про зміну терапії все ще бракує, відомо, що якщо активність захворювання не покращиться щонайменше на 50% протягом 3 місяців, ймовірність досягнення ремісії або НАЗ низька. Також рішення про використання конкретних інструментів повинно враховувати прямий вплив інгібіторів IL-6 та JAK на виробництво протеїнів гострої фази. Ця рекомендація залишилася незмінною. (Рівень доказовості – 2b, сила рекомендації – В)
4. Метотрексат (МТХ) повинен бути частиною першої стратегії лікування (без змін). MTX залишається основним препаратом при РА; це не тільки ефективний зс-ХМАРП сам по собі, але він також є основою для комбінованої терапії з глюкокортикоїдами (ГК) або з іншими зс-ХМАРП, б-ХМАРП або тс-ХМАРП. Важливо ще раз зазначити, що MTX (призначається перорально або підшкірно) слід титрувати до щотижневої дози приблизно 0,3 мг/кг, і що це наростання повинно здійснюватися протягом 4–6 тижнів. У Західній півкулі оптимальна терапевтична доза буде приблизно 20–25 мг на тиждень, тоді як в Азії - відповідно до меншої маси тіла та різної фармакогенетики серед населення Східної Азії - доза буде нижчою, наприклад, 16 мг в Японії. Важливість призначення фолієвої кислоти є ще одним центральним аспектом терапії MTX. Пацієнти часто пов'язують MTX з різними побічними діями, які пов'язані в першу чергу з його використанням як ліків від злоякісних новоутворень у великих дозах; отже, під час спільного процесу прийняття рішень навчання пацієнтів, включаючи подолання страхів від потенційних побічних ефектів, є настільки ж важливим для цього «старого» препарату, як і для нових агентів.
Як і в минулому, були певні дискусії щодо того, чи повинна перша стратегія лікування включати б-ХМАРП або тс-ХМАРП, однак не було знайдено нових доказів, які б припускали, що сучасний підхід, особливо з урахуванням рекомендацій, повинен бути змінений. Дійсно, жоден б-ХМАРП + MTX ще не показав переваги порівняно з MTX + ГК у пацієнтів, які не отримували MTX, а тс-ХМАРП ще не порівнювали з MTX + ГК як початкову терапію. Більше того, немає більш тривалих негативних наслідків при застосуванні цього підходу, оскільки ініціація МТХ у пацієнтів з раннім РА та подальше додавання інгібітора TNF (TNFi) через 6 місяців дає загальні результати, такі як використання комбінації MTX + TNFi з самого початку, при цьому багато пацієнтів вже досягли терапевтичної мети без використання б-DMARD. Таким чином, це рішення ґрунтувалося як на доказовій базі щодо ефективності та безпеки різних початкових терапевтичних підходів у пацієнтів з ранньою РА, так і на економічних міркуваннях. (Рівень доказовості - 1a, сила рекомендації – A)
5. У пацієнтів, які мають протипоказання до MTX, лефлуномід або сульфасалазин слід розглядати як частину (першої) стратегії лікування. Було коротко обговорено, чи слід розглянути прямий крок до б-ХМАРП або тс-ХМАРП, якщо протипоказаний МТХ, але жодних доказів, які порівнюють будь-який із цих препаратів у монотерапії лефлуномідом або сульфасалазином у комбінації з ГК, наразі немає. Також було запропоновано додати до цієї рекомендації антималярійні засоби. Як було сказано в попередніх документах, антималярійні засоби і особливо гідроксихлорохін мають обмежене місце, в основному для пацієнтів із легким РА. Оскільки в цілому для РА не знайдено нових доказів щодо ефективності гідроксихлорохіну і в дослідженнях було виявлено лише слабку клінічну та структурну ефективність, було вирішено зберегти фокус на сульфасалазині та лефлуноміді. У деяких країнах, особливо в Азії, інші препарати, такі як буціламін або ігуратимод, були дозволені при РА, однак ці препарати тут не розглядалися за недостатньою кількістю даних в інших регіонах. (Рівень доказовості - 1a, сила рекомендації – A)
6. Короткочасні ГК слід враховувати при ініціації або зміні зс-ХМАРП в різних режимах дозування та шляхах введення, але їх слід зменшити настільки швидко, наскільки це клінічно можливо (без змін). В історії цих рекомендацій було набагато менше дискусій щодо використання ГК, ніж будь-коли раніше, і існувала одностайність, що їх слід застосовувати в першу чергу як місткову терапію до тих пір, поки зс-ХМАРП не покажуть свою ефективність. Невиконання цілі лікування щодо звуження або відміни ГК після місткової фази слід розцінювати як збій цієї терапевтичної фази і, таким чином, об’єднувати б-ХМАРП або тс-ХМАРП з зс-ХМАРП. Що стосується дебатів щодо того, чи слід надавати перевагу лікуванню б-ХМАРП або тс-ХМАРП над зс-ХМАРП та ГК, принаймні три випробування показали подібні результати, коли MTX + ГК порівнювали з MTX + б-ХМАРП і з тих пір не публікувалися нові дані, що суперечать цій думці; тс-ХМАРП ще не порівнювали з MTX + ГК. (Рівень доказовості - 1a, сила рекомендації – A)
7. Якщо мета лікування не буде досягнута за допомогою першої стратегії зс-ХМАРП, за відсутності поганих прогностичних факторів слід розглядати інші зс-ХМАРП (без змін). Погані прогностичні фактори були визначені багато років тому і показані в таблиці 1. Висловлювалось припущення, що збій початкового лікування МТХ + ГК також був включений до цього списку; однак ця пропозиція не знайшла достатньої підтримки робочої групи. Оскільки додавання ГК як до першого зс-ХМАРП, так і до наступної терапії зс-ХМАРП настійно рекомендується, розгляд «інших зс-ХМАРП» тут означає або перехід, або додавання іншого зс-ХМАРП. Як було детально описано у 2016 році, комбінації зс-ХМАРП не розглядаються як найкращі в порівнянні з монотерапією MTX цільовою групою, особливо якщо MTX поєднується з ГК. Одне дослідження (CareRA) оцінювало пацієнтів з раннім РА з високим і низьким ризиком і показало, що більш м'яке втручання (MTX порівняно з MTX + ГК) також призводило до подібних результатів, але не існує досліджень, які б оцінювали таку стратегію у пацієнтів, яким не допоміг MTX. З іншого боку, відомо, що пацієнти, які не отримують MTX, часто реагують на наступний курс зс-ХМАРП. (Рівень доказовості - 5, сила рекомендації – D)
8. Якщо мета лікування не буде досягнута за допомогою першої стратегії зс-ХМАРП і наявні погані прогностичні фактори, слід додати б-ХМАРП або тс-ХМАРП. В оновленнях на 2019 рік є дві основні зміни. Робоча група переглянула перевагу б-ХМАРП над тс-ХМАРП через нові свідчення щодо успішної довгострокової ефективності та безпеки JAKi.
Що стосується першої зміни, то робоча група також погодилася, що б-ХМАРП і тс-ХМАРП мають в середньому аналогічну ефективність, і, отже, не можна надавати перевагу жодному з цих агентів з міркувань ефективності. У той час, як два дослідження показали статистичну перевагу барицитинібу або упадацитінібу порівняно з адалімумабом (все в поєднанні з МТХ), третє дослідження з використанням тофацитинібу + МТХ не показало такої переваги. Таким чином, загальна клінічна значимість невеликих відмінностей у клінічних випробуваннях не вважалася достатньо переконливою, щоб цільова група віддала перевагу тс-ХМАРП перед б-ХМАРП.
Пефіцитиніб був затверджений в Японії, де клінічні випробування показали значну ефективність; в глобальному дослідженні ефективність не була подібною, очевидно, через високі ефекти плацебо.
Упадацитиніб пройшов випробування фази ІІІ у різних популяціях РА у вигляді комбінованої та монотерапії, що додало документально підтвердженої ефективності цього класу препаратів.
Ападацитиніб тим часом затверджувався FDA по 15 мг щодня з різними попередженнями, що додаються до інформації про призначення лікарських засобів, включаючи попередження про те, що у пацієнтів, які отримували JAKis, траплялися тромбози.
Для філготинібу очікується публікація подальших результатів ІІІ фази, і препарат зараз проходить нормативну оцінку.
Що стосується безпеки, JAKi слід застосовувати з обережністю пацієнтам з високим ризиком виникнення тромбоемболічних подій. Більше того, наразі інформація щодо цього ризику ще не є остаточною і не накопичується, і не зрозуміло, які механізми можуть спричинити цей ризик; це має стати головною ціллю досліджень. Таким чином, рішення, який препарат призначити, коли пацієнту не вдалося досягти цілі лікування за допомогою першої терапевтичної стратегії, має ґрунтуватися на сукупності протипоказань, переваг пацієнта та витрат.
Друга зміна стосується того, що б-ХМАРП або тс-ХМАРП слід "додавати", а не "розглядати" і з більш сильною підтримкою комбінованої терапії (пункт 9), ніж раніше. У попередні роки дослідження літератури виявляли докази подібної ефективності серед б-ХМАРП, включаючи біосиміляри, затверджені EMA або FDA.
Ніяких нових досліджень ефективності зс-ХМАРП після попередньої неефективності MTX (або інших зс-ХМАРП) не проводилося з моменту останнього оновлення, але під час обговорень останнього оновлення було знайдено достатньо доказів, що свідчать про те, що користь від цього підходу обмежена. Зважаючи на те, що витрати на б-ХМАРП та тс-ХМАРП у багатьох країнах зменшилися з моменту появи біосимілярів, члени цільової групи вважали, що цю рекомендацію слід посилити. (Рівень доказовості - 1a, сила рекомендації – A)
9. б-ХМАРП і тс-ХМАРП повинні поєднуватися з зс-ХМАРП; у пацієнтів, які не можуть використовувати зс-ХМАРП в якості медикаментозної терапії, інгібітори IL-6 та тс-ХМАРП можуть мати деякі переваги порівняно з іншими б-ХМАРП (без змін). На відміну від клінічної практики, коли до 40% пацієнтів перебувають на монотерапії б-ХМАРП, комбінована терапія є ефективнішою порівняно з монотерапією для всіх б-ХМАРП та тс-ХМАРП. Коли MTX є частиною такої комбінованої терапії, високі дози MTX можуть не знадобитися: у поєднанні з TNFi (та іншими методами терапії) 10 мг на тиждень може бути достатнім для підвищення ефективності б-ХМАРП. Тоцилізумаб і сарилумаб як монотерапія ефективніші, ніж монотерапія адалімумабом, а монотерапія JAKi також має хорошу клінічну ефективність. (Рівень доказовості – 1а, сила рекомендації – А)
10. Якщо б-ХМАРП або тс-ХМАРП не допомагають, слід розглянути можливість лікування іншим б-ХМАРП або тс-ХМАРП; якщо одна терапія TNFi не вдалася, пацієнти можуть отримати препарат з іншим MOA або другим TNFi. Перша частина цієї рекомендації залишається незмінною. Друга частина зазнала незначної модифікації, змінивши послідовність: "інший MOA" перед "іншим TNFi". Ця поправка ґрунтувалася на деяких звітах із даних реєстру, спостережних дослідженнях та рандомізованому контрольованому дослідженні, що дозволяє припустити, що використання іншого MOA призводить до кращої ефективності, ніж іншого TNFi. Однак ці та подібні інші дослідження мали високий ризик зміщення, і мета-аналіз рандомізованих контрольованих випробувань не виявив відмінностей у ефективності між переходом на інший TNFi та з використанням іншого класу препаратів. Ця рекомендація стосується не лише неефективності TNFi, а скоріше неефективності будь-якого б-ХМАРП або тс-ХМАРП. Хоча дані про ефективність TNFi після неефективності іншого TNFi були доступні вже давно. На момент систематичного огляду літератури не було даних про дослідження (1) інгібіторів IL-6R після попередньої неефективності іншої такої сполуки (наприклад, сарилумабу замість тоцилізумабу), (2) JAK після неефективності іншого (наприклад, барицитиніб після тофацитиніб) або (3) б-ХМАРП після неефективності тс-ХМАРП. Однак, з того часу нещодавній пост-спеціальний аналіз клінічного випробування показав деяку ефективність сарилумабу після неефективності тоцилізумабу. Потрібно вважати, що термін "другий TNFi" не стосується біоподібного невдалого з'єднання, а молекулярно іншого TNFi. (Рівень доказовості – 1а, сила рекомендації – А)
11. Якщо пацієнт перебуває в стійкій ремісії після зниження прийому глюкокортикоїдів, можна розглянути звуження б-ХМАРП або тс-ХМАРП, особливо якщо це лікування поєднується з зс-ХМАРП. Під час обговорень учасники цільової групи підсилили запропоновану послідовність (припиняючи вживання ГК спочатку та згодом, коли ціль лікування буде підтримуватися, зменшуючи б-ХМАРП або тс-ХМАРП). Повторюючи цей принцип, який був запроваджений вже у 2010 році та зберігається з тих пір робоча група чітко підтвердила вимогу стійкої ремісії перед початком зменшення дози або збільшенням інтервалу б-ХМАРП або тс-ХМАРП. Важливо зазначити, що припинення прийому б-ХМАРП часто асоціюється із загостренням (збільшуючись із часом після припинення прийому), і тому багато членів цільової групи вважають за краще зменшення дози або збільшення інтервалу, а не відміну препарату; однак переважна більшість (>80%) пацієнтів із загостренням можуть відновити хороший результат після відновлення попереднього лікування.
Визначення терміну "стійка ремісія" немає, оскільки жодне дослідження не визначало, чи є 3, 6 або 12 місяців ремісії більш прийнятними для такого визначення; в деяких дослідженнях для цього було використано 6 місяців ремісії, але це повинно бути частиною програми досліджень. Кілька досліджень показали чіткий взаємозв'язок ризику загострення з невдачею досягти "глибокої" або "точної" ремісії до звуження б-ХМАРП; однак це не було визначено однозначно в недавньому систематичному огляді літератури через суперечливі дані дослідження. Загострення після звуження б-ХМАРП пов'язані з прогресуванням ураження суглобів, особливо коли це призводить до тривалого збільшення активності захворювання. Важливо, що невелике збільшення ураження суглобів може стати значним з роками і призвести до незворотної інвалідності.
Таким чином, загальна, стійка ремісія пов'язана з найнижчим ризиком загострення та зменшенням прийому препаратів, тоді як при низькій активності захворювання не рекомендується зменшення терапії через більш високий ризик загострень. Крім того, слід особливо обережно підходити до зменшення терапії у пацієнтів із ураженням суглобів, оскільки у них високий ризик прогресування при повній відміні б-ХМАРП, подібно до пацієнтів з підвищеним рівнем протеїнів гострої фази або залишкової (низької) активності захворювання, що не спостерігається при зменшенні дози. Як додатковий дискусійний пункт у цьому відношенні, було запропоновано розглянути можливість продовження б-ХМАРП (або тс-ХМАРП) під час відміни зс-ХМАРП. Однак недавнє рандомізоване дослідження, яке досліджувало це питання, не дало різниці в результатах між цими двома стратегіями; таким чином, з міркувань вартості та безпеки, комітет все ще підтримує, що спочатку обмежуватись повинні б-ХМАРП і тс-ХМАРП, а не зс-ХМАРП. (Рівень доказовості – 1b, сила рекомендації – А)
12. Якщо пацієнт перебуває в стійкій ремісії, може бути розглянуте звуження зс-ХМАРП. Під час обговорення комбінування рекомендацій 11 та 12, остаточним рішенням цільової групи було залишити їх окремо та не змінювати цей пункт. Цей пункт стосується насамперед двох аспектів: (1) у пацієнтів, які добре відреагували на зс-ХМАРП і не потребують б-ХМАРП або тс-ХМАРП, доза зс-ХМАРП може бути зменшена при стійкій ремісії та (2) у пацієнтів, які перебувають на комбінованій терапії і у яких повільне зменшення дози або підвищення інтервалу б-ХМАРП або тс-ХМАРП в кінцевому рахунку призводить до припинення цієї додаткової терапії з підтримкою стійкої ремісії, можна також розглянути можливість зменшення дози зс-ХМАРП. Однак потрібно мати на увазі, що РА вважається невиліковним захворюванням, і не можна припиняти прийом лікарського засобу, що має ефективність та переноситься пацієнтом. Що стосується питання про припинення порівняно з продовженням зс-ХМАРП у стадії ремісії, то зараз нових досліджень не знайдено. Старіше дослідження, яке порівнювало виведення та продовження зс-ХМАРП у пацієнтів, які перебувають у стадії ремісії, виявило значне збільшення частоти загострень. (Рівень доказовості – 2b, сила рекомендації – B)
Джерело:https://bit.ly/3bARosY