European Society for Medical Oncology (ESMO), 2018
Анемія та дефіцит заліза (ДЗ) - часті ускладнення у пацієнтів із солідними пухлинами чи гематологічними злоякісними захворюваннями, особливо у тих, які отримували хіміотерапію. Найчастіше анемія пов’язана з втомою, порушенням фізичної функції та зниженням якості життя. Наслідки анемії можуть включати порушення реакції на лікування раку та зниження загальної виживаності (ЗВ), хоча причинно-наслідковий зв’язок ще не встановлений.
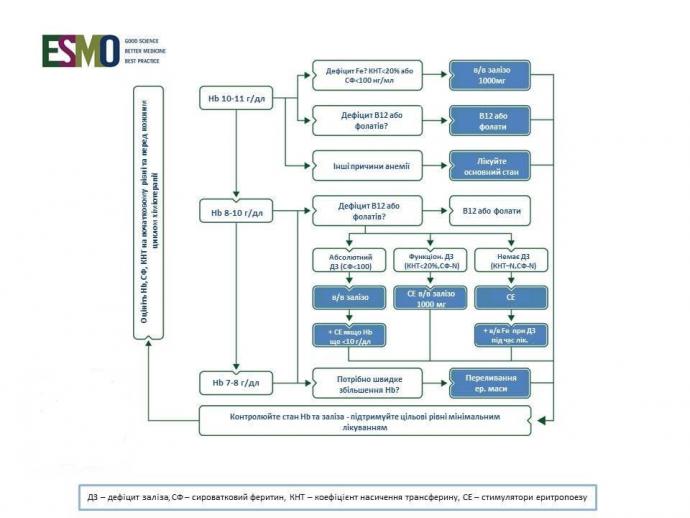
Цей новий клінічний гайдлайн ESMO надає інструменти для оцінки анемії у пацієнтів із мієлодиспластичними синдромами (МДС), та містить рекомендації щодо безпечного менеджменту анемії, спричиненої хіміотерапією (ПХА – пост-хіміотерапевтична анемія), за допомогою стимуляторів еритропоезу (СЕ), препаратів заліза для внутрішньовенного (в/в) або перорального введення, трансфузії еритроцитів та комбінації цих методів лікування. Основними цілями менеджменту анемії є - зменшення або усунення симптомів, особливо втоми, та поліпшення якості життя з мінімально інвазивним етіотропним та безпечним лікуванням, яке корегує основні причини та виявляється безпечним. Основні причини анемії (порушення еритропоетичної активності та порушення гомеостазу заліза) можуть виникати через посилене вивільнення запальних цитокінів внаслідок основного захворювання та/або токсичності терапії раку. Крім того, дефіцит вітаміну В12 та фолатів є відносно рідкісними причинами анемії у хворих на рак.
Зокрема, також для більш, ніж половини хворих на МДС характерний рівень гемоглобіну (Hb) <10 г/дл, що призводить до зниження функціональних можливостей та якості життя, і > 80% цих пацієнтів потребують переливання еритроцитарної маси. Однак стимулятори еритропоезу не були схвалені Європейським агентством із лікарських засобів (ЕМА – European medicines agency) для використання у хворих з МДС, незважаючи на те, що вони ефективно використовувалися при МДС протягом принаймні 20 років; їх активність була продемонстрована в численних клінічних випробуваннях, у яких були опубліковані дані для більш, ніж 2500 пацієнтів, які лікувались СЕ. Рандомізовані клінічні випробування тривають.
Окремі аспекти безпеки різних варіантів лікування були розглянуті в кількох аналізах та оглядах протягом останніх років, хоча дані про використання переливання крові у хворих на рак є рідкісними. Тому нові рекомендації ESMO щодо діагностики та лікування анемії й ДЗ у хворих на рак були визнані необхідними. Крім того, ці вказівки включають аспекти, пов’язані з лікуванням анемії у пацієнтів із МДС, та оновлення останніх інструкцій ESMO та European LeukemiaNet (ELN) щодо лікування MДС.
Лікування анемії у пацієнтів із солідними пухлинами або гематологічними злоякісними захворюваннями
Стимулятори еритропоезу (СЕ)
Показано, що СЕ збільшують рівень Hb та зменшують потребу в трансфузії еритроцитарної маси у хворих на рак, які отримують хіміотерапію, і затверджені для лікування ПХА з 1993 року. Крім того, мета-аналіз 23 досліджень, в яких повідомлялося про результати якості життя, показав статистично значущу різницю між пацієнтами, які отримували СЕ та контролем при поєднанні параметрів якості життя та симптомів, пов'язаних із втомою та анемією (табл. 3). Однак автори вважали цей висновок клінічно не важливим. І навпаки, досвід пацієнтів, які відповідають на терапію, і нещодавно опублікований мета-аналіз 37 рандомізованих контрольованих досліджень із 10 581 пацієнтом свідчать про невелике, але клінічно важливе поліпшення симптомів, пов’язаних з анемією.
Оскільки дослідження раннього встановлення дози епоетину бета не показали різниці у відповіді на Hb до 5000 та 10 000 МО/добу (що відповідає 500 та 1000 МО/кг/тиждень у пацієнта масою 70 кг), а оскільки не існує жодного дослідження при збільшенні дози, що показує користь, ескалація дози пацієнтам, які не реагують протягом 4–8 тижнів, не рекомендується (за винятком низької стартової дози епоетину тета, що збільшується вдвічі через 4 тижні, якщо реакція на Hb <1 г/дл). Натомість лікування СЕ слід припинити, якщо не виникають ознаки реакції Hb. Немає доказів різної ефективності серед СЕ (табл. 4), і не можна давати рекомендацій щодо переходу від одного продукту до іншого у разі недостатньої реакції. Через можливі проблеми безпеки ми продовжуємо рекомендувати забороняти вживати препарати без взаємозамінності, належного нагляду та повідомлення про це лікуючого лікаря [V, C].
Чи пов’язані СЕ зі смертністю та прогресуванням пухлини?
Наприкінці 2000-х років безпеку СЕ обговорювали, коли мета-аналізи припускали, що лікування СЕ може вплинути на смертність у онкологічних хворих, особливо якщо цільовий рівень Hb перевищує 12 г/дл. Отже, рекомендований цільовий діапазон Hb для лікування СЕ становить 10–12 г/дл, і слід уникати підйому Hb > 2 г/дл протягом 4 тижнів. Останній огляд Cochrane включав аналізи підгруп та показав статистично значущу смертність при дослідженні у пацієнтів із вихідною концентрацією Hb > 12 г/дл, але не для Hb <10 г/дл та Hb - 10–12 г/дл, які відповідають затвердженій на даний момент межі для початку та цільового діапазону Hb для терапії СЕ. Виключаючи одне дослідження з цільовим діапазоном Hb вище позначених настанов (цільовий Hb - 12–14 г/дл), ефект втратив статистичну значимість [коефіцієнт шансів; 95% довірчий інтервал (CI): 1,09 (0,97–1,23)]. Дані великих досліджень та інших мета-аналізів не вказували на вплив ШОЕ на ризик прогресування захворювання. Якщо різні СЕ однаково підходять, слід використовувати продукт із найнижчою вартістю придбання для курсу лікування. Загалом, в даний час немає клінічних доказів (ні поодиноких досліджень, ні мета-аналізів), які б вказували на вплив СЕ на стимулювання прогресування захворювання або рецидив, коли вони використовуються в межах мітки та дотримуються рекомендацій щодо лікування ПХА [I, A].
Еритропоетинові рецептори та збільшення пухлини
Деякі доповіді свідчать про потенційну роль рецептора еритропоетину (EпоР) у пухлинних клітинах у прогресуванні пухлини, проте була дискусія щодо того, чи були тести на експресію EпоР достатньо специфічними та про те, чи достатньо перевірена функціональність виявленого EпоР. Зокрема, у перших публікаціях, що пропонують експресію EпоР у ракових клітинних лініях, були використані поліклональні антитіла, тоді як в останніх публікаціях було використано моноклональні (більш специфічні) антитіла проти EпоР і не вдалося показати такий рецептор. Результати, що показують, що еритропоетин може антагонізувати анти-HER2 терапію при раку молочної залози за допомогою Jak2 опосередкованої передачі, свідчать про подальше дослідження цього шляху. У моделях пухлин на тваринах еритропоетин не посилював проліферацію ліній пухлинних клітин і не впливав на смертність.
СЕ, ризик та профілактика тромбоемболічних подій
Венозні тромбоемболічні події (ВТП) є відомим ризиком при використанні СЕ у пацієнтів із раком, а ризик виникнення ВТП збільшується в 1,5 рази. Найважливішими факторами ризику ВТП є високий гематокрит, старший вік, тривала іммобілізація, злоякісне захворювання, велика операція, множинна травма, попередня ВТП та хронічна серцева недостатність. Крім того, типи пухлин (наприклад, рак підшлункової залози) та схеми лікування (наприклад, лікування СЕ та/або імуномодулюючі препарати при множинній мієломі) пов'язані з підвищеним ризиком ВТП. Клінічні докази того, чи СЕ додатково збільшує ризик при застосуванні до імуномодулюючих методів лікування леналідомідом або талідомідом у пацієнтів із множинною мієломою, не є переконливим і може залежати від використовуваних методів лікування та схеми дослідження. Не рекомендується проводити профілактичне антитромботичне лікування, і слід дотримуватися вказівок ESMO щодо ВТП через відсутність проспективних рандомізованих досліджень, які б показали, що антитромботична терапія знижує ризик ВТП у пацієнтів, які отримували СЕ. Інші вказівки в цій галузі видаються Національною загальною онкологічною мережею (NCCN) та Американським товариством клінічної онкології (ASCO). Зокрема, ВТП можуть бути частково пов'язані з тромбоцитозом, який корелює з ДЗ, який може виникнути через швидке споживання наявного заліза при посиленому синтезі еритроцитів після лікування СЕ, але це ще належить дослідити. Загалом, окремі ризики та шкода повинні бути збалансованими та обговорені з пацієнтом.
Дефіцит заліза у пацієнтів із солідними або гематологічними злоякісними захворюваннями
ДЗ визначається недостатньою доступністю заліза для клітинних функцій, найбільш яскравим є синтез гема для еритропоезу. Абсолютний ДЗ - це виснаження запасів заліза, тоді як функціональний ДЗ - недостатня доступність, незважаючи на нормальне депо заліза; це може бути пов’язано або із захопленням заліза, або з підвищеними потребами в залізі під час еритропоетичної терапії. У хворих на рак абсолютний ДЗ обумовлений переважно кровотечею, тоді як інші причини, такі як недостатнє всмоктування заліза в кишечнику, наприклад, через неправильне харчування зазвичай мають незначний вплив. Найголовніше, що гомеостаз заліза у хворих на рак часто порушується через вивільнення прозапальних цитокінів та регуляцію гепцидину, головного регулятора всмоктування та вивільнення заліза. Підвищений рівень гепцидину призводить до недостатнього постачання заліза та функціональної ідентифікації за рахунок інтерналізації феропортину, найважливішого трансмембранного каналу для експорту заліза з ентероцитів та макрофагів у циркуляцію.
У 2006 році EORTC рекомендував лікування залізом для корекції ДЗ перед початком терапії СЕ і рекомендував застосовувати в/в залізо у пацієнтів з абсолютним або функціональним ДЗ у оновленому довіднику 2007 року. Однак ніяких подробиць щодо оцінки стану заліза або дозування не було надано через обмежені докази на той час.
Оцінка вмісту заліза
ДЗ відображається низькою насиченістю трансферину (КНТ <20%) і далі може бути охарактеризований як абсолютний ДЗ (виснажені запаси заліза, феритин сироватки <30 нг/мл) або функціональний ДЗ (адекватні запаси заліза з нормальним або підвищеним феритином у сироватці крові). Хоча дослідження депо заліза кісткового мозку до цих пір вважається стандартним, рівень циркулюючого феритину в клінічній практиці використовується для розмежування абсолютного та функціонального ДЗ. У незапальних умовах рівень феритину в сироватці крові <30 нг/мл вказує на абсолютний ДЗ, тоді як більш високі рівні зазвичай відображають відповідні запаси заліза. Однак при ракових захворюваннях та інших станах із активацією каскаду запальних реакцій феритин діє як запальні цитокіни. Отже, його рівень повинен бути підвищений до 100 нг/мл у пацієнтів із запаленням або раком. Інші біологічні маркери ДЗ включають гіпохромні, мікроцитарні еритроцити, низький вміст клітинних Hb в ретикулоцитах та підвищений відсоток гіпохромних еритроцитів (% HYPO > 5%), як маркерів абсолютного та функціонального ДЗ. Рівні розчинного рецептора трансферину (sTfR) та протопорфірину цинку підвищуються у пацієнтів з абсолютним ДЗ, але значення sTfR, як правило, в межах норми або низьке при функціональному ДЗ, за винятком того, що спостерігається під час лікування СЕ. Помітно, рівень sTfR може бути знижений після хіміотерапії, тоді як він збільшується у пацієнтів із підвищеною еритропоетичною активністю (або лікування СЕ) та супутньою хіміотерапією, що обмежує актуальність sTfR як показника стану заліза.
Переливання еритроцитарної маси (Ер. маси)
Переливання Ер. маси має тривалу історію застосування з користю для пацієнтів, які мають виражені симптоми анемії або кровотечі та потребують швидкого підвищення рівня Hb та гематокриту до нормальних лабораторних значень. Література про трансфузії Ер. маси у популяції раку, в основному, отримується від пацієнтів, які перенесли операцію. Пацієнти з незагрозливими анеміями, пов’язаними з раком та ПХА часто отримують переливання Ер. маси як звичайне лікування, незважаючи на обмежені докази для значного ефекту лікування, якщо не кориговане основне захворювання.
Успіхи в молекулярному тестуванні на відомі патогени та потенційну несумісність донора-реципієнта з часом поліпшили загальну безпеку переливання Ер. маси. Тим не менш, залишається ризик передачі невідомих або нових збудників до розробки та впровадження ефективних тестів (табл. 3) та підвищеного ризику інфікування через імуносупресію, пов'язану з переливанням. Крім того, збережена алогенна кров може викликати протромботичні, а також запальні реакції («ураження при зберіганні»). В умовах онкологічної хірургії великі популяційні дослідження та мета-аналіз пропонують незалежні зв'язки між трансфузією Ер.маси та підвищеним ризиком смертності, захворюваності та рецидиву раку відповідно. Мета-аналізи досліджень, що порівнюють обмежені та вільні пороги трансфузії Ер. маси, головним чином у пацієнтів з ортопедичними, серцево-судинними станами або кровотечами, показали значне зменшення частки переливань та кількості трансфузійних одиниць Ер.маси без негативного впливу на смертність, захворюваність та функціональний результат. Аналіз досліджень із обмежувальним порогом Hb <7 г/дл показав значне зниження загальної та внутрішньолікарняної смертності, повторної кровотечі, гострого коронарного синдрому, набряку легенів та бактеріальних інфекцій з обмежувальним підходом порівняно з більш вільною стратегією. В умовах онкології, Американське суспільство гематології згідно кампанії Choosing Wisely та інші товариства щодо лікування анемії рекомендують переливати лише мінімальну кількість Ер.маси, необхідної для полегшення важких симптомів анемії або для відновлення безпечного діапазону Hb (наприклад, 7–8 г/дл у стабільних несерцевих хворих).
Рекомендується переливання зарезервованою Ер.масою, насамперед пацієнтам із вираженою симптоматикою анемії, які потребують швидкої корекції Hb [II, B]. Концепція вжиття всіх адекватних заходів для збільшення та підтримання ендогенної Ер. маси пацієнта на ранніх стадіях та для захисту її протягом усього лікування, таким чином, попереджуючи переливання крові, була розроблена для неонкологічної популяції і називається «менеджмент кров’ю пацієнтів» (МКП). Він базується на трьох принципах, а саме: 1) оптимізація власної маси еритроцитів пацієнта, 2) мінімізація втрати крові й кровотечі та 3) оцінка фізіологічної толерантності до анемії. Це повинно супроводжуватися супутньою, всебічною оцінкою гематологічного стану пацієнта на початковому етапі та протягом терапії. MКП вже добре зарекомендував себе в галузі ортопедичної хірургії та з Австралійським національним товариством крові. Детальний огляд досліджень, в яких оцінювали вплив трансфузії на результати пацієнтів (включаючи ішемічні події як другу провідну причину смерті у хворих на рак), гарантовано, але він виходить за рамки цих керівних принципів.
Лікування анемії у хворих на МДС
Зокрема, лікування анемії, пов'язаної з МДС, відрізняється за кількома аспектами від вищезазначених рекомендацій щодо солідних пухлин або інших гематологічних злоякісних новоутворень, таких як множинна мієлома або лімфома. Виходячи з наявних даних та опублікованих прогностичних балів, ці рекомендації щодо лікування анемії (табл. 1) та інші міжнародні, а також національні рекомендації щодо лікування МДС включали рекомендації щодо використання СЕ для менеджменту анемії, пов’язаної з МДС. Використання досліджуваних методів лікування (пропонованих як лікування другої лінії), які зараз перевіряються в клінічних випробуваннях, більш детально обговорюється в гайдлайнах клінічної практики ESMO для MДС. Багато хворих із МДС, які мають нормальний або навіть збільшений запас заліза через неефективний еритропоез, а також через регулярні переливання Ер.маси, потребують хелації заліза для зменшення перевантаження. Інші ризики та обмеження трансфузії Ер. маси, не характерні для MДС, обговорюються в окремому розділі "Переливання Ер. маси" вище.