Відомо, що при сексуальних контактах передається більше 30 видів різних бактерій, вірусів і паразитів. Чотири з найбільш поширених інфекцій в даний час виліковні - це сифіліс, гонорея, хламідіоз і трихомоніаз. Ще чотири інфекції є вірусними і не виліковуються - це гепатит В (HBV), вірус простого герпесу (ВПГ, або герпес), ВІЛ і вірус папіломи людини (ВПЛ).
ІПСШ передаються переважно при сексуальних контактах, включаючи вагінальний, анальний і оральний секс. Мікроорганізми, що викликають ІПСШ, можуть також поширюватися при переливанні крові та пересадці тканин. Багато ІПСШ, включаючи хламідіоз, гонорею і, головним чином, гепатит В, ВІЛ та сифіліс - можуть також передаватися від матері до дитини під час вагітності та пологів.
Щодня більше одного мільйона людей заражаються ІПСШ. За оцінками ВООЗ, щорічно 357 мільйонів людей заражаються однією з чотирьох ІПСШ - хламідіозом (131 млн), гонореєю (78 мільйонів), сифілісом (5,6 мільйона) або трихомоніазом (143 мільйони). Більше 500 мільйонів людей живуть з інфекцією генітального ВПГ (герпесу). На будь-який момент часу більше 290 мільйонів жінок інфіковані ВПЛ, однією з найбільш поширених ІПСШ.
Передача ІПСШ від матері до дитини може призводити до мертвонародження, смерті новонародженого, народження дитини з низькою масою тіла, недоношеності, сепсису, пневмонії, неонатального кон'юнктивіту і вроджених вад. Більш 900 000 вагітних жінок були інфіковані сифілісом, що призвело приблизно до 350000 випадків смерті плодів і новонароджених в 2012 році. Інфекція ВПЛ щорічно призводить до 528 000 випадків захворювання на рак шийки матки і до 266 000 випадків смерті від раку шийки матки.
Такі ІПСШ, як гонорея і хламідіоз, є основними причинами запальних захворювань органів малого тазу, несприятливих наслідків вагітності та безпліддя.
Як відомо, будь-яку інфекцію краще профілактувати, аніж лікувати, тому у чинних міжнародних керівництвах наявні рекомендації для виявлення ІПСШ та їхнього скринінгу з деякими вказівками для різних груп населення.
• Невагітні жінки, які не мають підвищеного ризику ІПСШ
У жінок, які не мають підвищеного ризику ІПСШ, клініцисти повинні враховувати вік пацієнта під час призначення скринінгових тестів. USPSTF рекомендує проводити скринінг на хламідіоз, гонорею та ВІЛ-інфекцію (якщо раніше не проводилось тестування) у всіх сексуально активних жінок віком від 18 до 24 років, які не мають підвищеного ризику. Для сексуально активних жінок 25 років і старше, які не піддаються підвищеному ризику, USPSTF рекомендує провести скринінг на ВІЛ, якщо раніше він не проводився.
• Невагітні жінки, які мають підвищений ризик ІПСШ
USPSTF рекомендує скринінг на гонорею, хламідіоз, ВІЛ-інфекцію, сифіліс та HBV-інфекцію у сексуально активних жінок різного віку, які мають підвищений ризик.
• Чоловіки
USPSTF рекомендує проводити скринінг на сифіліс, ВІЛ-інфекцію (якщо раніше тестування не проводилось) та інфекцію HBV (якщо не проводилось вакцинації або якщо статус вакцинації невідомий) у чоловіків з підвищеним ризиком. Недостатньо доказів того, що скринінг чоловіків, які мають високий ризик або всіх чоловіків на хламідіоз чи гонорею зменшує ймовірність передачі, власне передачу або ускладнення будь-якої інфекції.
• Вагітні жінки
Загалом, лікарі повинні визначати статус ризику вагітної жінки, використовуючи ті ж самі фактори ризику, як і для невагітних жінок (наприклад, статева поведінка з високим ризиком, вік). Через наслідки інфекції для новонародженого та необхідність запровадження лікування новонароджених, USPSTF рекомендує провести скринінг всіх вагітних жінок на інфекцію HBV, ВІЛ-інфекцію та сифіліс. USPSTF також рекомендує проводити скринінг на хламідіоз і гонорею у всіх вагітних жінок 24 років і молодше, а також у вагітних жінок старшого віку, які піддаються підвищеному ризику.
Інтервали сканування
За відсутності хороших досліджень щодо інтервалів скринінгу, USPSTF припускає, що розумний підхід полягає у повторному тестуванні пацієнтів, якщо статевий анамнез включає нові чи стійкі фактори ризику після останнього негативного результату тесту.
На жаль, більшість пацієнтів звертаються до лікаря, коли у пацієнта вже з’являються симптоми захворювання, які викликають дискомфорт. У такому випадку лікар призначає специфічні тести для виявлення та підтвердження того чи іншого захворювання.
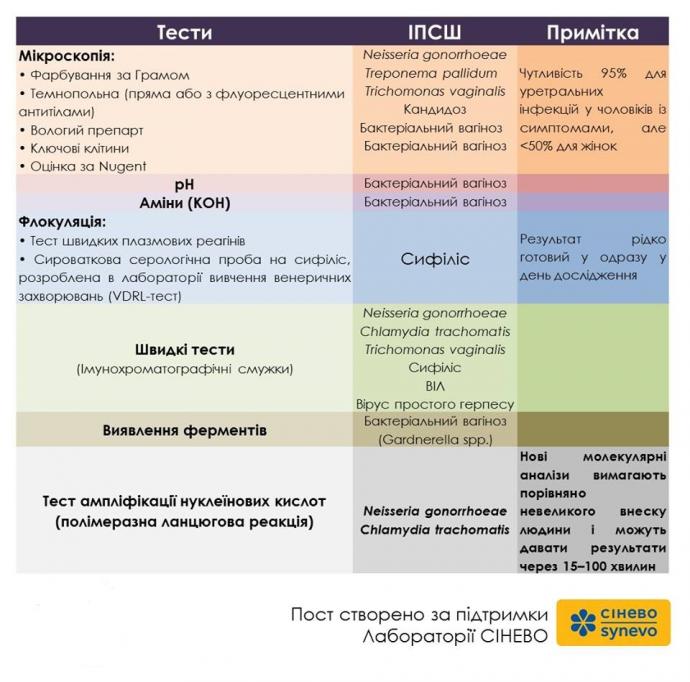
ЯКІ Ж НАЯВНІ МЕТОДИ ДІАГНОСТИКИ ІПСШ?
Науковий прогрес забезпечив широкий спектр тестів для ідентифікації ІПСШ. Ці тести дуже сильно відрізняються з точки зору рівня їх складності (тобто технічних вимог до оптимальної продуктивності тесту), від витрат, необхідних для їх виконання (як матеріальних, так і пов'язаних з роботою), і з точки зору результативності. Таким чином, кожен тип діагностичного тесту має свої переваги і недоліки. Внаслідок цього в деяких рекомендаціях найточніший тест може бути не найкращим тестом для використання, якщо він настільки дорогий, що його не можна використовувати для тестування великої кількості осіб або якщо такий тест надто складний у виконанні. Таким чином, пропускна здатність тесту (кількість тестів, виконаних за певний проміжок часу) також враховується при виборі тесту. Загалом, діагностичні тести можуть бути розділені на щонайменше три різних типи.
По-перше, безпосереднє виявлення самих мікроорганізмів є найбільш очевидним підходом до діагностики ІПСШ. Їх можна виявити за допомогою мікроскопії та відповідного фарбування або вологого приготування для візуалізації патогенів. Виявлення культури, антигену або виявлення нуклеїнових кислот з використанням ампліфікованих або неампліфікованих тестів виявлення нуклеїнових кислот часто є більш чутливими методами, ніж мікроскопія, але може мати більш складні технічні вимоги до оптимальної продуктивності тестування і може збільшити інтервал між тестуванням і наявністю результатів випробувань. Для багатьох важливих ІПСШ (сифіліс і ВІЛ) виявлення реакції людини на інфекцію (наявність антитіл) є сприятливим діагностичним тестом. Сила серологічних тестів полягає в тому, що вони можуть бути корисними не тільки для діагностики, але й для спостереження.
Усі серологічні тести можуть мати випадкові хибні результати. Проблема хибно-позитивних серологічних тестів часто може бути вирішена шляхом тестування зразків, які виявилися позитивними під час первинного скринінгу з використанням іншого, підтверджуючого серологічного тесту, який спрямований на інший антиген. Деякі серологічні тести можуть диференціювати нещодавно зараження від більш давніх або раніше лікованих інфекцій шляхом виявлення IgM для недавніх інфекцій. Недоліком серологічної діагностики є те, що антитіла до патогена ІПСШ можуть зберігатися довго після успішного лікування. По-третє, є тести, які виявляють мікробні метаболіти, такі як матеріали, що змінюють рН генітального секрету і біогенні аміни. Ці тести є корисними доповненнями для діагностичних цілей у деяких налаштуваннях. Прикладом цього є важливість рН в діагностиці бактеріального вагінозу.
МІКОПЛАЗМОЗ
Для практичних цілей діагностика M. genitalium обмежується тестом ампліфікації нуклеїнових кислот (наприклад, ПЛР), оскільки культуральний метод займає надзвичайно багато часу (кілька місяців), є технічно складним та нечутливим. До теперішнього часу не було виявлено жодних серологічних тестів, тестів виявлення антигенів або тестів на ефект від лікування, які виявилися б корисними для діагностики інфекцій урогенітальної інфекції M. genitalium.
Більшість таких аналізів полімеразної ланцюгової реакції (ПЛР) базуються на виявленні гена адгезину MgPa M. genitalium. Деякі частини гена MgPa, є сильно змінними, і праймери, спрямовані на ці області, не будуть належним чином працювати з клінічними зразками. Для деяких аналізів ПЛР гена 16S рРНК виявлення M. genitalium базується на ампліфікації за допомогою універсальних праймерів Mollicutes (мікоплазми і уреаплазми) і подальшої гібридизації з видоспецифічними зондами.
ГОНОРЕЯ
Гонорея часто перебігає безсимптомно, особливо у жінок, і з локалізацією в глотці і прямій кишці, і симптоми, якщо вони присутні, можуть бути неспецифічними. Діагноз гонореї встановлюється за допомогою ідентифікації N. gonorrhoeae у генітальних або позагенітальних виділеннях. Правильно підготовлений, фарбований за Грамом і мікроскопічно досліджений мазок для виявлення грамнегативних внутрішньоклітинних диплококів у поліморфноядерних лейкоцитах є чутливим (95%) і специфічним (97%) для діагностики гонореї у чоловіків із симптомами та уретральним виділенням. Однак у жінок, збудника в мазках цервікального секрету виявляють лише в 40–60% випадків, що може бути пов’язане з меншою кількістю гонококів у жінок. Можливі хибно-позитивні результати, а специфічність (80–95%) залежить від досвіду мікроскопіста. Наразі, не рекомендоване застосування прямого мікроскопічного дослідження для діагностики ректальних і глоткових інфекцій через велику кількість інших присутніх організмів і низьку чутливість. Скринінг безсимптомних осіб шляхом мікроскопії не рекомендується.
Протягом багатьох десятиліть культуральний метод вважався «золотим стандартом» для діагностики як генітальних, так і екстрагенітальних форм гонореї. Культуральний метод є чутливим і високоспецифічним в оптимізованих умовах, недорогим і, що важливо, дозволяє проводити дослідження антибіотикостійкості. Протягом останніх двох десятиліть були розроблені і впроваджені ПЛР для виявлення специфічної ДНК / РНК N. gonorrhoeae. Вони є, як правило, більш чутливими, ніж культуральний метод для діагностики гонореї, особливо для фарингеальних і ректальних зразків.
Тести, які диференціюють види Neisseria: традиційно здатність N. gonorrhoeae виробляти кислоту з використанням нею глюкози, виявляється шляхом зміни кольору індикатора рН внаслідок зниження рН, порівняно з, напр. N. meningitidis, який додатково використовує мальтозу. Цю унікальну картину утилізації вуглеводів виявляють шляхом інокуляції чистих культур в цистеїновий триптіказний агар, що містить глюкозу, мальтозу та сахарозу відповідно, при кінцевій концентрації 1–2% після 24-годинної інкубації. Важливо виконати цей тест з використанням чистої культури; це може вимагати принаймні однієї субкультури, що призведе до збільшення часу для ідентифікації, ніж інші більш швидкі тести. Також ефективним є тест на швидке споживання вуглеводів, який залежить від попередньо сформованих ферментів, а не від росту, використовуючи рідкі середовища, інокульовані чистими бактеріями, які дають результати через 4 години. Швидке виявлення попередньо сформованих ферментів також вимагає чистої культури (яка завжди повинна бути взята з неселективного середовища), але не вимагає добової інкубації для тесту і забезпечує більш швидкі результати.
ХЛАМІДІОЗ
Технології діагностики хламідій продовжують розвиватися і забезпечують підвищення чутливості. Завдяки чудовим експлуатаційним характеристикам ПЛР рекомендується для діагностики та скринінгу хламідійних інфекцій.
Молекулярні технології забезпечують найкращу чутливість з відмінною специфікою. Також вони зменшують необхідність у строгих умовах транспортування та зберігання та виключають суб'єктивний аналіз (наприклад, мікроскопію).
Швидкі тести пропонують розширені можливості для надання негайного лікування. У деяких ситуаціях призначення емпіричного лікування може компенсувати нижчу чутливість цих тестів порівняно з ПЛР. Не рекомендовано використовувати серологічні методи для діагностики неускладненої урогенітальної інфекції C. trachomatis.
Рекомендовано використовувати серологію лише як допоміжний метод для діагностики та/або скринінгу для ускладнених інфекцій C. trachomatis, неонатальної пневмонії та венеричної лімфогранульоми, а також в епідеміологічних дослідженнях.
ТРИХОМОНІАЗ
Існують чотири основні класи лабораторно-діагностичних аналізів: волога мікроскопія, ідентифікація антигенів, культуральний метод і тести ампліфікації нуклеїнових кислот (найбільш поширена – ПЛР). Волога мікроскопія може бути проведена в клінічних умовах і в поєднанні з тестуванням на бактеріальний вагіноз. Це ідеальний діагностичний метод першої лінії, тобто, якщо він позитивний, він забезпечує остаточний діагноз з високою специфічністю, при умові, що він адекватно виконаний і інтерпретований. «Тестування на місці» тепер широко доступне.
Вищеперераховані методи схвалені тільки для дослідження вагінальних зразків жінок. Останнє покоління цих тестів, напр. OSOM Trichomonas Rapid Test (Genzyme Diagnostics, США) має чудову чутливість порівняно з мікроскопією і може забезпечити результати приблизно через 30 хвилин, тобто, поки пацієнт чекає. Це забезпечує можливість негайного лікування інфекцій в даному випадку, що є перевагою цього тесту над методами, які потребують направлення до центральної лабораторії. Культуральний метод вимагає час для проведення - 5–7 днів після збору, а для визначення позитивних результатів необхідна мікроскопія. Також ПЛР доступна для виявлення специфічної ДНК або РНК T. vaginalis. Для програм, які використовують тести ампліфікації нуклеїнових кислот (ТАНК) для хламідіозу та гонореї, включення тестування на T. vaginalis може бути доцільним.
Було описано ряд методів для виявлення антитіл до T. vaginalis. Однак тести на антитіла мають низьку чутливість і субоптимальну специфічність для виявлення поточної інфекції T. vaginalis і не повинні використовуватися для рутинної діагностики трихомоніазу.
БАКТЕРІАЛЬНИЙ ВАГІНОЗ
Діагноз бактеріальний вагіноз (БВ) - це клінічний синдром, що характеризується підвищеною кількістю вагінальних виділень з неприємним запахом. Діагноз ґрунтується на наявності принаймні трьох з чотирьох наступних критеріїв (критерії Amsel):
• однорідні біло-сірі в’язкі виділення;
• рН вагінальних виділень > 4,5;
• поява рибного запаху вагінального вмісту при змішуванні з розчином 10% гідроксиду калію (КОН);
• наявність «ключових клітини» при мікроскопічному дослідженні.
Оцінка цього захворювання суб'єктивна. Виділень у жінок з БВ часто незначно більше, ніж у здорових жінок. Значення рН піхвової рідини слід вимірювати за допомогою смужок з індикаторним папером для рН відповідного діапазону (3,8-6,0). Зразки збирають за допомогою мазків з бічних і задніх склепінь піхви, а потім тампоном доторкаються безпосередньо до паперової смужки. Слід уникати контакту зі слизом шийки матки, оскільки він має рН > 7,0.
Нормальна зріла піхва має кислий рН 4,0. При БВ рН підвищений до > 4,5. Оцінка вагінального рН має найвищу чутливість із чотирьох характеристик, але найнижчу специфічність; підвищений рН також спостерігається, якщо вагінальні виділення містять менструальну кров, слиз шийки матки або сперму, і у жінок з інфекцією T. vaginalis. Жінки з БВ часто скаржаться на неприємний запах піхви. Цей запах обумовлений вивільненням амінів, що виробляються шляхом декарбоксилювання амінокислот лізину (до кадаверину) і аргініну (до путресцину) анаеробними бактеріями. Коли КОН додається до вагінальної рідини, ці аміни відразу стають нестійкими, утворюючи типовий рибний запах. У деяких частинах світу КОН не є доступним через його каустичну природу і тому, якщо виконуються лише три з чотирьох критеріїв, Чутливість діагностики втрачається. Ключові клітини - сквамозні епітеліальні клітини, покриті багатьма дрібними кокобацилярними організмами, що дають шорсткий, гранулярний аспект; краї цих епітеліальних клітин чітко не визначені, внаслідок великої кількості бактерій і явної дезінтеграції клітин. У більшості пацієнтів з БВ видно суміш нормальних вагінальних епітеліальних клітин, які відшарувались, і 20% або більше ключових клітин.
ВУЛЬВОВАГІНАЛЬНИЙ КАНДИДОЗ
Діагноз вульвовагінальний кандидоз (ВВК) зазвичай встановлюють на комбінації клінічних проявів і мікроскопії препарату. Класичні симптоми і ознаки ВВК включають свербіж піхви, сирнисті білі виділення, печіння вульви, дизурію і еритему статевих губ і вульви. Однак, симптоми і ознаки, часто більш сумнівні. Виявлення дріжджових клітин, що брунькуються, за допомогою вологого мазку або з використанням гідроксиду калію (KOH) може проводитися в лабораторії або в клініці і має дуже високу прогностичну цінність для діагностики ВВК. У деяких центрах для діагностики кандидозу кращим є використання пофарбованого за Грамом мазка і ідентифікація брунькованих клітин дріжджів і псевдогіф у жінок з аномальними вагінальними виділеннями, а при відсутності мікроскопа - виявлення рН 4,5. Папір з вузьким діапазоном рН є недорогим, чутливим і простим способом використання і доступний у більшості установ. Культуральне дослідження є найбільш чутливим методом, який в даний час доступний для виявлення Candida spp., але його слід використовувати з обережністю, оскільки Candida spp. зустрічаються також у жінок без ВВК. Таким чином, культуральний метод слід розглядати лише за умови, що клінічно підозрюється ВВК, але результати мікроскопії є негативними, або коли необхідне визначення антимікробної чутливості. Молекулярне виявлення Candida spp. з використанням ПЛР було описано, але не дає переваг порівняно з існуючими тестами, оскільки висока чутливість, продемонстрована методом ПЛР, виявить дріжджі Candida spp. у жінок без ВВК і призведе до гіпердіагностики і непотрібного лікування.
ГЕНІТАЛЬНЙИ ГЕРПЕС
Генітальна герпетична інфекція часто діагностується за клінічними ознаками внаслідок наявності кластера везикулярних уражень. Лабораторні методи, які використовуються для діагностики інфекції вірусу простого герпесу (ВПГ), включають безпосереднє виявлення ВПГ в матеріалі з уражень і непрямих серологічних методів. Доступні тести для ВПГ включають детекцію антигену, вірусну культуру і ПЛР для вірусної ДНК, а також використання серологічних аналізів для виявлення впливу ВПГ шляхом виявлення антитіл до первного типу ВПГ. Вірусна культура з подальшим введенням герпесу стала наріжним каменем діагностики ВПГ протягом останніх двох десятиліть. Однак виявлення ДНК ВПГ у клінічних зразках з використанням ампліфікованого молекулярного тестування (метод вибору – ПЛР) тепер є альтернативним методом, оскільки він в чотири рази більш чутливий, менш залежний від умов збору та транспортування, і швидший, ніж визначення вірусної культури.
Пряме вивчення зразків та цитологічне дослідження з використанням звичайних процедур фарбування (мазки Tzanck, плями Papanicolaou або Romanovsky) виявили низьку чутливість і специфічність і не повинні використовуватись для діагностики герпесвірусної інфекції. При наявності шкірно-слизових ушкоджень вірусний антиген у зразках з уражених ділянок може бути виявлений за допомогою прямого імунофлюоресцентного (ІФ), імунопероксидазного (ІП) фарбування або імуноферментного аналізу (ІФА). Прямий ІФ метод може бути класифікований як швидкий діагностичний тест, що дозволяє диференціювати тип генітального герпесу за допомогою клінічно-підготовлених мазків або лабораторно-приготованих зразків з мазків, що транспортуються в лабораторію. Антигени HSV-1 і HSV-2 можуть бути виявлені за допомогою типоспецифічних флуоресцентно-мічених моноклональних антитіл.
Герпетичні білки також можуть бути виявлені в клінічних зразках з використанням класичного захоплення ELISA з використанням HSV-специфічних поліклональних або моноклональних антитіл. Чутливість комерційно доступного ІФА, порівняно з чутливістю вірусної культури, більше або дорівнює 95% із специфічністю в межах від 62% до 100% у пацієнтів з симптомами. Однак, більшість комерційно доступних аналізів, не диференціюють HSV-1 від HSV-2. «Тестування на місці» для виявлення антигенів HSV комерційно доступні, але їх продуктивність не була широко оцінена.
Серологічне тестування на ВПГ не рекомендується рутинно проводити пацієнтам без симптомів, але воно є показаним в ряді груп населення (перший епізод генітального герпесу; сексуальні партнери хворих на генітальний герпес).
СИФІЛІС
Оскільки T. pallidum не може культивуватися на штучних середовищах, розроблені способи прямого виявлення, такі як темнопольна мікроскопія, пряма імунофлуоресценція (IФ), і тести для виявлення ДНК T. pallidum. Тест на інфекційність вже давно вважається «золотим стандартом» для прямого виявлення T. pallidum у клінічних зразках. Проте, цей тест проводиться рідко, за винятком дослідницьких лабораторій, оскільки є трудомістким (вимагає близько 1–2 місяців) і вимагає доступу до відповідного тваринного об'єкта (кроликів). ПЛР-тест дозволяє виявити еквіваленти ДНК <10 організмів у зразку, підсилюючи специфічні сегменти ДНК T. pallidum. Він може бути використаний для вивчення зразків з будь-якого ексудату ураження, тканини або рідини організму, і зразок може бути свіжим, замороженим, або фіксованим, парафіновим.
Серологічні тести на сифіліс можна розділити на два типи: нетрепонемні або реагінові тести, такі як реакція Вассермана (RW), швидкий реагент плазми, лабораторне дослідження венеричних захворювань і телуїдиновий тест червоної ненагрітої сироватки; і трепонемні тести, такі як FTA-Abs, аналіз гемагглютинації T. pallidum (TPHA), пасивний аналіз агглютинації частинок T. pallidum (TPPA), ELISA, хемілюмінесценція і переважна більшість «тестів на місці» або швидких тестів, які комерційно доступні у теперішній час.
ВЕНЕРИЧНА ЛІМФОГРАНУЛЬОМА
До початку 1980-х років виділення C. trachomatis в культурі клітин залишалося основним методом діагностики хламідійної інфекції. Виявлено, що ізоляти від випадків ВЛГ швидше ростуть у клітинах тканинних культур, ніж не-L-хламідійні ізоляти. Починаючи з середини 1990-х років, ПЛР-діагностика стала найбільш доцільним методом вибору для діагностики хламідійних інфекцій. Згодом були розроблені молекулярні аналізи, які можуть диференціювати штами на основі делеції, яка відбувається в гені pmpH тільки в ізолятах ВЛГ. Значення серології в діагностиці ЛГВ проктиту і проктоколіту залишається невідомим.
ВІРУС ПАПІЛОМИ ЛЮДИНИ
Імунна реакція господаря на ВПЛ включає як гуморальний, так і клітинно-опосередкований компонент. Після первинного інфікування відповідь гуморальних антитіл є типоспецифічною і первинно виявляється через 6–18 місяців після зараження. Реакція є слабкою і лише приблизно 50–60% індивідуумів, які заражені ВПЛ, мають антитіла. Після первинного інфікування індивідуум може залишатися ДНК-позитивним, незважаючи на розвиток специфічних антитіл; такі особи не захищені від розвитку подальшого захворювання під впливом ВПЛ. Серологічні тести на ВПЛ не використовуються з діагностичною метою. Поствакцинальне серологічне дослідження використовується для оцінки ефективності вакцини.
Тестування на ВПЛ спирається на молекулярні методи. Це пояснюється тим, що, як зазначалося раніше, традиційні культуральні методи не можуть вирощувати ВПЛ і серологічні тести є відносно нечутливими. Рекомендованим дослідженням для виявлення ВПЛ є ПЛР-тест.
ВІРУС ІМУНОДЕФІЦИТУ ЛЮДИНИ
Серологічна діагностика ВІЛ-інфекції зазвичай здійснюється шляхом виявлення антитіл до ВІЛ у крові або інших біологічних рідинах. Антитіла з’являються в середньому приблизно через 4–6 тижнів після зараження, хоча в деяких випадках поява антитіл може затримуватись до 3–6 місяців після зараження. Таким чином, ВІЛ-інфекція не може бути виключена на підставі негативного тесту через 4–6 тижнів після ймовірного зараження. Під час початкового періоду реплікації вірусу антитіла відсутні, і ВІЛ не може бути діагностовано лише за допомогою тестів, що містять тільки антитіла.
Період «вікна» може бути скорочений за допомогою методів, які можуть безпосередньо виявити один або більше компонентів (p24 антиген або РНК) ВІЛ. Виявлення ВІЛ-специфічних антитіл є дуже надійним маркером для діагностики ВІЛ-інфекції.
Незабаром після виявлення ВІЛ були розроблені ферментні імунологічні тести для діагностики ВІЛ-інфекції. Вони були більш чутливими і специфічними для виявлення антитіл до ВІЛ; однак, вони все ще не виявляли найпершої, ранньої відповіді у вигляді антитіл класу IgM, внаслідок їхніх особливостей і конструкції. Ферментні імунотести третього покоління використовують сендвіч-формат, який включає антигени, мічені ферментом, і здатен виявляти ранні IgM, зменшуючи тим самим період «вікна». Протягом останніх років було розроблено новий тест четвертого покоління для подальшого зменшення віконного періоду, об'єднавши виявлення вірусного антигену (p24) на додаток до антитіл до ВІЛ. Ці комбіновані EIA антиген-антитіла є дуже чутливими до виявлення гострої ВІЛ-інфекції до періоду появи антитіл і в даний час регулярно використовуються для скринінгу крові / продуктів крові у багатьох країнах.
Оскільки розроблені експрес-тести для виявлення антитіл до ВІЛ протягом декількох хвилин (1–15 хв), порівняно з ферментними аналізами, які можуть займати до 2–4 годин, прилади оптимізовані для прискорення взаємодії антиген-антитіло. Це вимагає використання високої концентрації антигену і виявлення комплексів антиген-антитіло з чутливими кольоровими реагентами, такими як колоїдне золото.
Діагностика ВІЛ можлива за допомогою виявлення РНК, ДНК або р24 ВІЛ, а також шляхом безпосереднього виявлення вірусних компонентів (p24 антиген, РНК або провірусна ДНК). Ідентифікація вірусу культуральним або іншими методами зазвичай не проводиться через погану чутливість порівняно зі стандартними імунологічними або молекулярними методами і складністю методів вірусного культивування. Виявлення антигену р24 або РНК або ДНК ВІЛ-1 відіграє важливу роль, коли діагноз на основі антитіл встановити неможливо, наприклад, у випадку перинатального зараження у новонароджених або виявлення гострої інфекції у дорослих до моменту розвитку антитіл до ВІЛ.
Тестування на рівень CD4-лімфоцитів використовується в клінічному моніторингу ВІЛ-інфікованих людей для визначення відповідного часу для початку АРТ, для моніторингу ефективності лікування АРТ і для визначення того, коли необхідно забезпечити профілактику опортуністичних інфекцій.
Хоча рівень CD4 є важливим клінічним параметром для розуміння клінічного статусу пацієнтів і ініціювання АРТ, вірусне навантаження є показником кількості ВІЛ в крові і є важливим параметром, що використовується для контролю ефективності лікування. Існує багато комерційно доступних аналізів на вірусне навантаження, які використовуються в основному для моніторингу якості лікування ВІЛ-інфекції в поєднанні з клінічною презентацією та іншими лабораторними тестами. Технологія ампліфікації нуклеїнової кислоти in vitro використовується для кількісної оцінки частинок ВІЛ в плазмі людини. Для кількісної оцінки РНК ВІЛ за допомогою ПЛР, ізотермічної ампліфікації нуклеїнової кислоти та ампліфікації сигналу використовують ПЛР зворотної транскриптази, ампліфікацію на основі послідовності нуклеїнових кислот і розгалужених ланцюгів ДНК (bDNA). Технології ненуклеїнових кислот базуються на виявленні вірусних ферментів (РТ) і білків (р24 антиген) як сурогатної міри навантаження на ВІЛ. Аналізи вірусного навантаження відрізняються чутливістю та динамічним діапазоном, а також здатністю виявляти та кількісно визначати різні підтипи ВІЛ.
ВИСНОВКИ:
• ПЛР є єдиним практичним методом діагностики M. Genitalium. Підготовка зразків та чутливість аналізу повинні бути оптимальними для тестування M. genitalium, оскільки цей збудник присутній в 100 разів в менших концентраціях, ніж C. trachomatis.
• Мікроскопічний метод виявлення N. gonorrhoeae є чутливим і специфічним у чоловіків із симптомами з виділенням уретри. Культуральний метод є чутливим та високоспецифічним в оптимізованих умовах, недорогим і дозволяє проводити тестування на антимікробну чутливість. ПЛР, як правило, має вищу чутливість порівняно з культурою, особливо для фарингеальних і ректальних зразків. Проте інколи для підтвердження можуть знадобитися додаткові ТАНК, які спрямовані на іншу послідовність.
• Завдяки чудовим експлуатаційним характеристикам, ПЛР рекомендується для діагностики та скринінгу хламідійних інфекцій. Однак вибір тестів залежить від наявних ресурсів та рівня лабораторної підтримки. Не рекомендовано використовувати серологічні методи для діагностики неускладненої урогенітальної інфекції C. trachomatis.
• «Тестування на місці» та культуральний метод мають більш високу чутливість для діагностики хламідіозу, ніж мікроскопія. Відповідні та перевірені ТАНК (як варіант – ПЛР) мають чудову чутливість щодо інших діагностичних методів. Мікроскопія повинна бути виконана та інтерпретована протягом 10 хвилин для отримання оптимальних результатів і має найвищу чутливість у жінок із симптомами.
Культуральний метод може бути використаний також для тестування чоловіків. Можливе поєднання ТАНК для одночасного виявлення хламідіозу та гонореї.
• Діагностика бактеріального вагінозу може бути проведена з використанням критеріїв Amsel, демонструючи наявність принаймні трьох з наступних чотирьох критеріїв: гомогенні в’язкі біло-сірі вагінальні виділення, pH >4,5, запах аміна та ключові клітини. Культура організмів, пов'язаних з БВ, не має діагностичної цінності.
• Діагноз кандидозу встановлюється за допомогою поєднання клінічних ознак і мікроскопії відповідного зразка. Культуральний метод повинен розглядатися при негативній мікроскопії за наявності клінічних симптомів. Тестування антимікробної чутливості Candida spp. іноді виправдовується і має виконуватися в спеціалізованих центрах.
• Лабораторні методи, які використовуються для діагностики інфекції ВПГ, включають безпосереднє виявлення ВПГ в матеріалі з уражених ділянок і непрямих серологічних методів. Доступні тести для ВПГ включають детекцію антигену, вірусну культуру і ПЛР-діагностику для вірусної ДНК, а також використання серологічних аналізів для виявлення впливу ВПГ шляхом виявлення антитіл проти ВПГ. При наявності шкірно-слизових ушкоджень вірусний антиген у матеріалі ураження може бути виявлений за допомогою прямого імунофлуоресцентного (ІФ), імунопероксидазного (ІП) фарбування або імуноферментного аналізу (ІФА). Рутинне серологічне тестування на ВПГ не рекомендується.
• ПЛР при сифілісі дозволяє виявити еквіваленти ДНК <10 організмів у зразку, підсилюючи специфічні сегменти ДНК T. pallidum. Вона може бути використана для вивчення зразків з будь-якого ексудату ураження, тканини або рідини організму, і зразок може бути свіжим, замороженим, або фіксованим, парафіновим.
• ПЛР стали методом вибору для діагностики хламідійних інфекцій (вагінального лімфогранульоматозу). Згодом були розроблені молекулярні аналізи, які можуть диференціювати штами на основі делеції, яка відбувається в гені pmpH тільки в ізолятах ВЛГ. Значення серології в діагностиці ВЛГ-проктиту і проктоколіту залишається невідомим.
• Серологія ВПЛ не використовується з діагностичною метою. Тестування на ВПЛ спирається на молекулярні методи. Рекомендованим дослідженням для виявлення ВПЛ є ПЛР-тест.
• Серологічна діагностика ВІЛ-інфекції зазвичай здійснюється шляхом виявлення антитіл до ВІЛ у крові або інших біологічних рідинах. Виявлення ВІЛ-специфічних антитіл є дуже надійним маркером для діагностики ВІЛ-інфекції. Виявлення ВІЛ РНК, ДНК або р24 ВІЛ також може бути діагностовано шляхом безпосереднього виявлення вірусних компонентів (p24 антиген, РНК або провірусна ДНК).